ブログBlog
IL-23 p19モノクローナル抗体製剤
ミリキズマブ(オンボー®)とリサンキズマブ(スキリージ®)の適応追加
グセルクマブ(トレムフィア®)の新規薬剤
小金井つるかめクリニックの川上智寛です。
2024年7月にIL-23p19モノクローナル抗体製剤についてお話して1年が過ぎました。
この1年で…以下の適応追加がありました。
- 2025年3月にミリキズマブ クローン病 適応追加
- 2025年3月にグセルクマブ 潰瘍性大腸炎 適応追加
- 2025年6月にグセルクマブ クローン病 適応追加
前回お話した内容に新規の情報を追加して今回説明させていただきます。
IL-23 p19モノクローナル抗体製剤は、インターロイキン-23(IL-23)のp19サブユニットを標的とするモノクローナル抗体です。
IL-23は、免疫系の細胞(特にヘルパーT細胞のうちTh17細胞)を活性化し、炎症を引き起こします。Th17細胞は炎症反応や免疫防御に関与しており、特に細菌や真菌の排除に重要な役割を担っています。ミリキズマブ、リサンキズマブ、グセルクマブはIL-23のp19サブユニットに特異的に結合し、IL-23の働きをブロックすることで過剰な免疫反応や炎症を抑える効果があります。
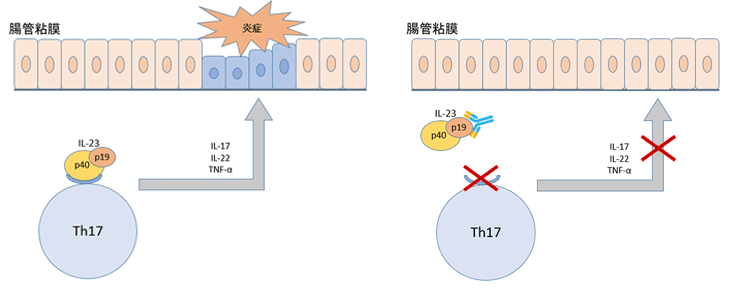
これら3剤は同じ作用機序を有していますが、適応症や投与スケジュールが異なります。
ミリキズマブ(商品名: オンボー)
【適応症】
中等症から重症の潰瘍性大腸炎 (既存治療で効果不十分な場合に限る)
中等症から重症の活動期クローン病 (既存治療で効果不十分な場合に限る)
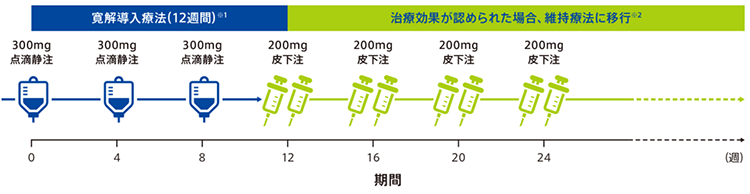
【投与スケジュール(潰瘍性大腸炎)】
寛解導入療法では初回・4週後・8週後に300 mgを点滴静注(30分以上かけて点滴)。
寛解維持療法では点滴静注療法を4週間隔で3回投与した後、4週間隔で1回200 mgの皮下注。
※12週時点で効果不十分な場合や維持療法中に効果減弱した場合は点滴静注製剤(300 mg)を4週間隔で3回投与することが認められています。
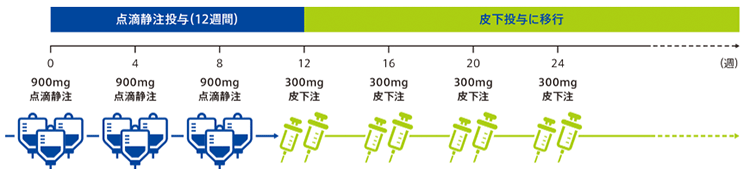
【投与スケジュール(クローン病)】
寛解導入療法では初回・4週後・8週後に900mgを点滴静注(300mgあたり30分以上かけて投与なので少なくとも90分以上かけて点滴)。寛解維持療法では点滴静注療法を4週間隔で3回投与した後、4週間隔で1回300 mgの皮下注。
※効果減弱した場合は点滴静注製剤(900mg)を4週間隔で3回点滴静注することができます。
ミリキズマブの皮下注射はシリンジとオートインジェクターの2タイプがあり、1本が100 mgと200mgの製品があります。
潰瘍性大腸炎は100mgを2本/回、クローン病は100mgと200mgを各1本ずつ合計2本/回を皮下注射で投与することになっています。
2024年6月~自己注射が可能となっています。自己注射の手技を習得いただければ受診間隔をあけることができます。
これまでミリキズマブの皮下注製剤には緩衝液としてクエン酸が添加されていました。
クエン酸は注射部位の痛みの主な原因とされており、ミリキズマブは注射時に痛みが出やすいとされていましたが、2025年〜にクエン酸無添加の製品に切り替わることになり、順次クエン酸無添加の注射に置き換わるので注射時の痛みが軽減することが期待されます。
- ・寛解導入の点滴静注1バイアルあたり30分の投与(潰瘍性大腸炎で30分、クローン病で1時間30分の点滴時間)である。
- ・皮下注製剤は2025年〜クエン酸無添加の製品に切り替わるため注射時の痛み軽減がはかられた。
- ・維持投与の皮下注は1ヶ月に1回の注射頻度だが、自己注射が認められているため手技を習得できれば受診間隔という点ではフレキシブルに対応できる。
リサンキズマブ(商品名: スキリージ)
【適応症】
尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症(2019年3月~)
中等症~重症の活動期クローン病(2022年9月)
掌蹠膿疱症(2023年5月)
中等症~重症の潰瘍性大腸炎(2024年6月)
皮下注射はオートドーザーを採用しています。皮膚に張り付けた機械のボタンを押すと自動的に5分かけて注入する仕掛けになっています。皮下注射の液量が2.4mlと比較的多いため、じっくり注入することで痛みが極力少なくなるような配慮であると思います。
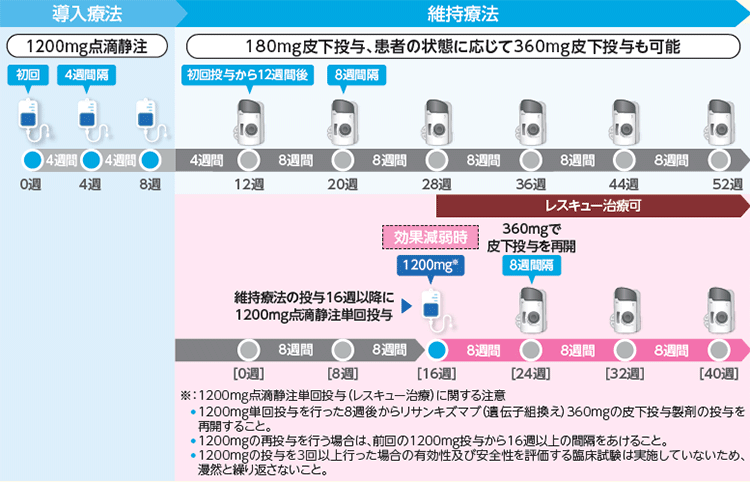
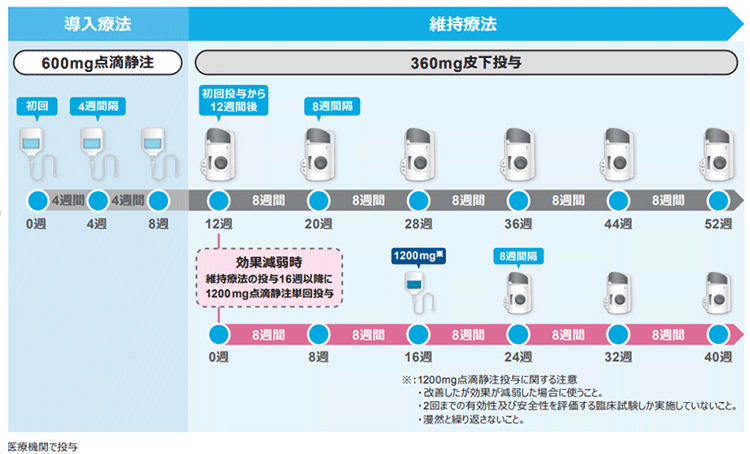
【投与スケジュール(潰瘍性大腸炎)】
寛解導入療法では初回・4週後・8週後に1200 mgを点滴静注(1200 mgの場合、2時間以上かけて点滴)。寛解維持療法では点滴静注を4週間隔で3回投与した後、初回投与から12週後に1回180 mgの皮下注を行い、以降、8週間隔で1回180mgの皮下注を継続します。(効果減弱時は1回360mgの皮下注を8週間隔で投与可能)。
寛解維持療法開始から16週以降に効果減弱がみられた場合は1200 mgの点滴静注を単回行うことができます。
【投与スケジュール(クローン病)】
寛解導入療法では初回・4週後・8週後に600 mgを点滴静注(600 mgの場合、1時間以上かけて点滴)。寛解維持療法では点滴静注を4週間隔で3回投与した後、初回投与から12週後に1回360 mgの皮下注を行い、以降、8週間隔で1回360 mgの皮下注を継続します。
寛解維持療法開始から16週以降に効果減弱がみられた場合は1200 mgの点滴静注を単回行うことができます。
- ・寛解導入の点滴静注1バイアルあたり60分の投与(潰瘍性大腸炎で3時間、クローン病で60分の点滴時間)である。
- ・維持投与の皮下注は2ヶ月に1回。医療機関を受診して投与することになる。
- ・潰瘍性大腸炎に対して、皮下注 180mg→360mgのオプションがある。
グセルクマブ(商品名: トレムフィア)
【適応症】
尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症(2018年3月~)
掌蹠膿疱症(2019年11月~)
中等症~重症の潰瘍性大腸炎(2025年3月~)
中等症~重症の活動期クローン病(2025年6月~)
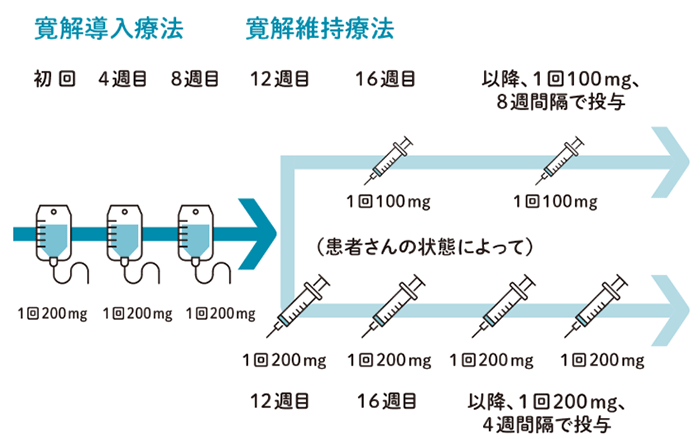
【投与スケジュール(潰瘍性大腸炎)】
導入療法
点滴静注製剤1回200mgを初回、4週後、8週後に点滴静注する。
維持療法
点滴静注製剤による導入療法終了8週後から、皮下注製剤1回100mgを8週間隔で皮下投与する。なお、患者の状態に応じて、点滴静注製剤による導入療法終了4週後以降に、1回200mgを4週間隔で皮下投与することもできる。
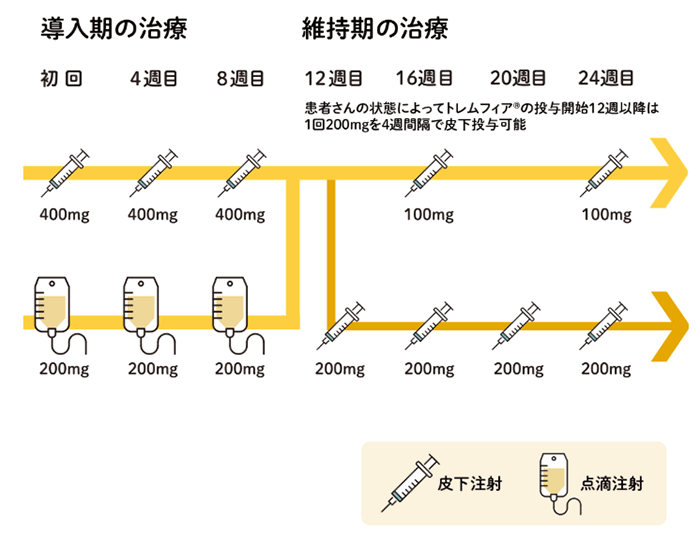
【投与スケジュール(クローン病)】
導入療法
- ①点滴静注製剤1回200mgを初回、4週後、8週後に点滴静注する
- ②皮下注製剤1回400mgを初回、4週後、8週後に皮下投与する。
①もしくは②のいずれか選択可能
維持療法
点滴静注製剤による導入療法終了8週後から、皮下注製剤1回100mgを8週間隔で皮下投与する。なお、患者の状態に応じて、点滴静注製剤による導入療法終了4週後以降に、1回200mgを4週間隔で皮下投与することもできる。
- ・クローン病におけるIL23製剤では唯一皮下注製剤による寛解導入治療が可能。
- ・点滴静注1バイアルあたり60分の投与(潰瘍性大腸炎とクローン病で用量が同じであるためどちらの場合でも60分の点滴時間)。
- ・維持投与の皮下注は100mgを2ヶ月に1回が基本(医療機関で注射)。
- ・潰瘍性大腸炎、クローン病どちらも200mgを1ヶ月に1回のオプション(期間短縮&倍量)が選択可能。
IL-23 p19モノクローナル抗体製剤の副作用について
主な副作用には注射部位の反応(赤み、腫れ、痛み)、頭痛や疲労感、感染症(風邪などの上気道感染症、水虫など)があります。1-5%未満で重篤な感染症やアナフィラキシーなどのアレルギー反応が報告されていますが、IL-23 p19モノクローナル抗体製剤に特有の副作用の報告はありません。
【ウステキヌマブとの違い】
炎症性腸疾患の領域でウステキヌマブ(ステラーラ®)というIL-12とIL-23の両方を抑制する薬剤が先に使用されています。IL-12の主な役割はウイルスや細菌への免疫応答や抗腫瘍効果などがあります。IL-23 p19モノクローナル抗体製剤と似た部分に作用する薬剤ですが、ミリキズマブ、リサンキズマブとグセルクマブがIL-23のみをブロックする点が異なります。
腸管のバリア機能が障害されたマウスモデルの研究で、大腸炎の発症はIL-12によって引き起こされていますが、慢性的な炎症になるにつれてIL-23に依存した炎症反応に変わっていくことが示されました。発症からの時間経過とともに優位なサイトカインが変化していく可能性が示唆されています。(Eftychi C, et al. Immunity. 2019;51:367-380)
尋常性乾癬の領域でウステキヌマブまたは抗TNFα抗体製剤であるアダリムマブに効果不十分な方を対象にリサンキズマブに切り替えた場合、皮膚症状が改善したという報告があります。(Bruce S, et al. J Dermatolog Treat.2022;33:2991-2996)
ウステキヌマブと比べてリサンキズマブ、ミリキズマブ、グセルクマブがIL-12を抑制しないことで安全面に対してプラスの影響があるのかどうか、慢性化した病態により効果が高いのかどうかは現時点で結論はでていません。乾癬領域の報告にあるように炎症性腸疾患でも他の薬剤からの切り替えでよい効果が得られるとも考えられます。
〜IL-23p19阻害薬の臨床試験データ〜
潰瘍性大腸炎(UC)
ミリキズマブ(オンボー®)
- •LUCENT-1(導入療法、12週)
中等症〜重症UC患者に300 mg静注を投与。
臨床的寛解率:24.2%(ミリキズマブ) vs13.3%(プラセボ)[P<0.001]。 - •LUCENT-2(維持療法、40週)
LUCENT-1で反応した患者を対象に200 mg皮下注(4週ごと)。
臨床的寛解率:49.9%(ミリキズマブ) vs25.1%(プラセボ)[P<0.001]。
リサンキズマブ(スキリージ®)
- •INSPIRE 試験(導入療法、12週)
1200 mg静注(0・4・8週)。
臨床的寛解率:20.3%(リサンキズマブ) vs6.2%(プラセボ)[P<0.001]。 - •COMMAND 試験(維持療法、52週)
導入反応者に180 mgまたは360 mg皮下注(8週ごと)。
臨床的寛解率:40.2%(180 mg)/37.6%(360 mg) vs25.1%(プラセボ)[P<0.001]。
グセルクマブ(トレムフィア®)
- •QUASAR 試験
中等症〜重症UCに対し、200 mg静注導入後に100 mg8週もしくは200mg4週の皮下注維持。 - •12週時の臨床的寛解率は22.6%(グセルクマブ) vs7%(プラセボ)、44週寛解率は100mg(8週) 45.2%, 200mg (4週) 50%。
〜 ポイント〜
潰瘍性大腸炎に関しては、現時点でウステキヌマブを対象にした大規模直接比較試験は行われていません。そのため「どの薬剤の効果が強いか」は言及できませんが、主要試験ではいずれもプラセボに対して有意な改善が示されています。
クローン病(CD)
ミリキズマブ(オンボー®)
- •VIVID-1 試験
中等症〜重症CD患者において、ウステキヌマブとの比較で非劣性を示した。
リサンキズマブ(スキリージ®)
- •SEQUENCE 試験
ウステキヌマブとの直接比較で、主要評価項目(52週臨床的寛解率)および副次項目(内視鏡的改善など)で優越性を示した。
グセルクマブ(トレムフィア®)
- •GALAXI-2/GALAXI-3 試験
いずれもウステキヌマブとの比較で、複数の主要・副次エンドポイントにおいて優越性を示した。
〜 ポイント〜
リサンキズマブ・グセルクマブ:ウステキヌマブに対して優越性あり。
ミリキズマブ:ウステキヌマブに対して非劣性あり。
ただし、各試験で対象患者背景(前治療歴、生物学的製剤使用歴)、試験デザイン(二重盲検か、評価時期、評価指標など)が異なるため、数値だけで「薬剤の効果」を単純比較することはできません。どの薬剤もウステキヌマブと比べて「同等」または「より有効」な結果が示されているといえます。
| 試験名 | 薬剤 (商品名) |
疾患 | 試験デザイン | 患者背景 | 投与方法・期間 | 主な結果 (臨床的寛解率) |
UST と の比較 |
|---|---|---|---|---|---|---|---|
| LUCENT-1 | ミリキズマブ (オンボー®) |
UC | 第 III 相、二重盲検、プラセボ対照 | 生物学的製剤既治療含む中等症~重症 UC | 導入:300 mg 静注 0,4,8 週 / 12 週評価 |
24.2% vs 13.3% (P<0.001) | なし |
| LUCENT-2 | ミリキズマブ (オンボー®) |
UC | 第 III 相、二重盲検、プラセボ対照 | LUCENT-1反応例 | 維持:200 mg 皮下注 4 週ごと / 40 週評価 | 49.9% vs 25.1% (P<0.001) | なし |
| INSPIRE | リサンキズマブ (スキリージ®) |
UC | 第 III 相、二重盲検、プラセボ対照 | 生物学的製剤既治療含む中等症~重症 UC | 導入:1200 mg 静注 0,4,8 週 / 12 週評価 |
20.3% vs 6.2% (P<0.001) | なし |
| COMMAND | リサンキズマブ (スキリージ®) |
UC | 第 III 相、二重盲検、プラセボ対照 | INSPIRE反応例 | 維持:180/360 mg 皮下注 8 週ごと / 52 週評価 | 40.2% / 37.6% vs 25.1% (P<0.001) |
なし |
| QUASAR | グセルクマブ (トレムフィア®) |
UC | 第 III 相、非盲検、プラセボ対照 | 生物学的製剤既治療含む中等症~重症 UC | 導入:200 mg 静注後 100 mg 皮下注維持 |
約 22% vs 7% (12 週) / 約 45-50% vs 18% (44 週) |
なし |
| VIVID-1 | ミリキズマブ (オンボー®) |
CD | 第 III 相、二重盲検、ウステキヌマブ対照 | 生物学的製剤既治療含む中等症~重症 CD | 導入 + 維持 | 非劣性達成 | 非劣性 |
| SEQUENCE | リサンキズマブ (スキリージ®) |
CD | 第 III 相、二重盲検、ウステキヌマブ対照 | 生物学的製剤既治療含む中等症~重症 CD | 導入 + 維持 | 優越性達成 | 優越性 |
| GALAXI-2,3 | グセルクマブ (トレムフィア®) |
CD | 第 III 相、二重盲検、ウステキヌマブ対照 | 生物学的製剤既治療含む中等症~重症 CD | 導入 + 維持 | 優越性達成 | 優越性 |
〜全体のまとめ〜
- *IL-23 p19モノクローナル抗体製剤の炎症性腸疾患領域における薬剤はミリキズマブ(オンボー®)とリサンキズマブ(スキリージ®)が使用されていたが、2025年にグセルクマブ(トレムフィア®)が追加となり3種類となった。
- *副作用として注射部位の反応や感染症などが報告されていますが、重篤な副作用は少なく、安全に使用可能である。
- *潰瘍性大腸炎、クローン病ともに各薬剤の効果について現時点で「差はない」。点滴に要する時間、皮下注射の投与間隔や効果不十分の際のオプションなどを含めて薬剤を選択することになる。
- アーカイブ
- 2026年02月(1)
- 2025年09月(2)
- 2025年06月(1)
- 2025年05月(1)
- 2025年01月(1)
- 2024年12月(1)
- 2024年10月(1)
- 2024年09月(1)
- 2024年08月(1)
- 2024年06月(1)
- 2024年05月(1)
- 2024年04月(1)
- 2024年03月(1)
- 2024年02月(1)
- 2024年01月(1)
- 2023年12月(1)
- 2023年11月(1)
- 2023年10月(1)
- 2023年09月(1)
- 2023年08月(1)
- 2023年07月(1)
- 2023年06月(1)
- 2023年05月(1)
- 2023年04月(1)
- 2023年03月(1)
- 2023年02月(1)
- 2023年01月(1)
- 2022年12月(1)
- 2022年11月(1)
- 2022年10月(1)
- 2022年09月(1)
- 2022年08月(1)
- 2022年07月(2)
- 2022年06月(1)
- 2022年05月(1)
- 2022年04月(1)
- 2022年03月(1)
- 2022年02月(1)
- 2022年01月(1)
- 2021年12月(1)
- 2021年11月(1)
- 2021年10月(1)
- 2021年09月(1)
- 2021年08月(1)
- 2021年07月(1)
- 2021年06月(1)
- 2021年05月(1)
- 2021年04月(1)
- 2021年03月(1)
- 2021年02月(1)
- 2021年01月(1)
- 2020年12月(2)
- 2020年11月(2)
- 2020年10月(2)
- 2020年09月(1)
- 2020年08月(2)
- 2020年07月(1)
- 2020年06月(1)
- 2020年05月(2)
- 2020年04月(2)
- 2020年03月(2)
- 2020年02月(2)
- 2020年01月(2)
- 2019年12月(2)
- 2019年11月(1)
- 2019年10月(1)
- 2019年09月(1)
- 2019年08月(1)






