ブログBlog
ヒト型抗ヒトTNFαモノクローナル抗体 ヒュミラ®(アダリムマブ)の追加承認について
皆様こんにちは。小金井つるかめクリニック 消化器内科の川上智寛です。今回は、ヒト型抗ヒトTNFαモノクローナル抗体 ヒュミラ®(アダリムマブ)に関して、潰瘍性大腸炎に対する使用法における追加承認がありましたので解説します。
ヒュミラは薬液の改良で注射に伴う痛みも少なくなったり、ペン型注射器が発売されたり、発売後もちょっとしたアップデートがありましたが、今回潰瘍性大腸炎に対する倍量投与 or 期間短縮投与の追加承認があったことが大きなニュースです。元になった臨床試験のデータを提示しながらお伝えします。なお、今回のテーマは非常にマニアックな内容であることをご容赦ください。
クローン病に対するヒュミラの使用方法(変更なし)
クローン病に対してのヒュミラの使用方法にあたっては、現在でも、効果減弱をきたした症例に対して倍量or期間短縮投与が認められています。この点は今回の追加承認にあたっては変更はありません。

潰瘍性大腸炎に対するヒュミラの使用方法(変更あり)
一方で、潰瘍性大腸炎に対しての生物学的製剤で、倍量や期間短縮が認められている薬剤はこれまでありませんでした。潰瘍性大腸炎に使用できる生物学的製剤は昔に比べて増えてきているもののまだ限りがあるため、「一度使い始めた薬剤をできるだけ工夫しながら長く使い続けてどうしてもコントロールが難しい場合に、別の生物学的製剤への変更を検討する」というのが一般的です。
今回のヒュミラの追加承認で薬の切り替えをすることなく、同一薬剤で“もう一工夫できる”オプションができたことはとても良いことです。
国際共同第Ⅲ相試験 SERENE試験
今回の追加承認の根拠となった臨床試験がSERENE試験です。SERENE試験はこれまでの標準用量と比較して高用量使用の有効性と安全性を検討した試験です。
この試験はベースラインから投与8週までの導入療法試験と投与8週から52週までの維持療法試験として実施されており、そのうち維持療法試験において高用量群(40mg毎週)と標準用量群(40mg隔週)の比較で、高用量群(40mg毎週)の優越性が認められたことにより追加承認になりました。
※導入試験は0週・1週・2週・3週目に160mg、4週・6週目に40mg皮下投与した群(高用量群)とこれまで通りの0週に160mg、2週目に80mg、4週・6週目に40mg皮下投与した群(標準用量群)にわけて比較検討していますが、主要評価項目で優越性がみられなかったため導入療法についてはこれまで通りの投与量のままとなっています。
患者背景については以下の通りです。前治療として他の抗TNFα抗体製剤を使用していた方が12%いて、臨床試験に登録された時点でステロイド使用があった症例が60%いることをふまえると、治療に難渋している症例もエントリーされていると考えられます。
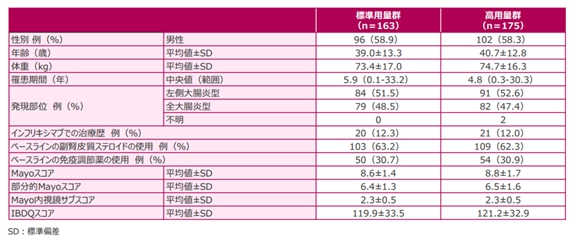
アッヴィ合同会社 社内資料より
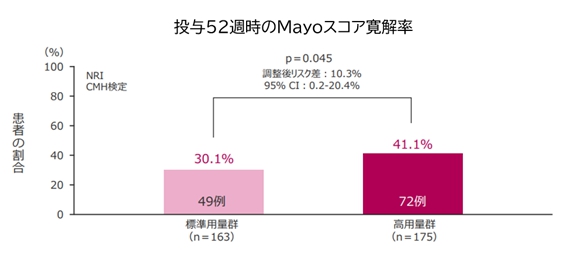
投与8週時のMayoスコア改善例(つまり治療によく反応した患者)における、投与52週時のMayoスコア寛解率(つまり初期治療によく反応した後、維持療法でもきちんと寛解を維持できた患者)は、標準用量群に対して高用量群の優越性が示されています。
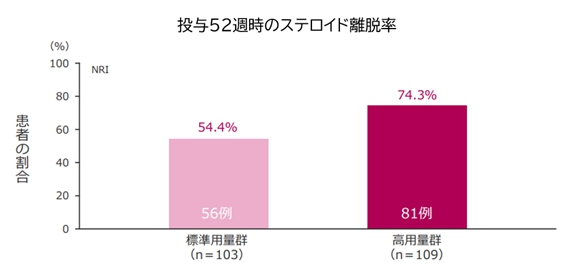
また、試験開始時にステロイドが投与されていた方の投与52週時のステロイド離脱(90日以上の離脱)が得られた割合(ステロイドは可能な限りやめたいので、ヒュミラ等の治療薬の上乗せでステロイドを離脱できることは治療の成功を意味します)は、標準用量群が54.4%, 高用量群が74.3%になっており、高用量群でやや高い結果でした。
ヒュミラ以外の抗TNFα抗体製剤の代表格であるインフリキシマブに関しては、ACT1/ACT2(参考)という、潰瘍性大腸炎に対するインフリキシマブの導入・維持療法の臨床試験データが引用されることが多いです。ACT1/ACT2では通常用量(5mg/kg)と高用量(10mg/kg)の比較をしていますが、有効性に大きな違いがみられず、安全性・有効性・医療経済的な要件を鑑み、5mg/kgが現在も採用されています。
今回、高用量のヒュミラで標準用量のヒュミラとの比較でMayoスコア寛解率の項目で有意差がでたことは個人的に驚きました。ステロイド離脱率については有意差こそでていないものの高用量群で高い結果になっていることも興味深いです。
(参考)Rutgeerts P, Sandborn WJ, Feagan BG, et al : Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 353 ; 2462― 2476 : 2005
ヒュミラの血中濃度
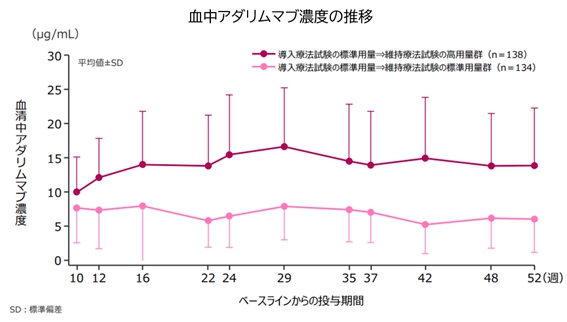
維持療法で高用量のヒュミラを投与された方と標準用量のヒュミラを投与された方の、ヒュミラ血中濃度を比較したグラフを示します。定常状態における平均血中濃度は高用量群で14-17μg/ml, 標準用量群で5-8μg/mlであり、概ね2倍の血中濃度を維持できています。
ヒュミラの高用量投与の安全性について
“治療薬と関連あり”とされた有害事象は標準用量で25.8% (89例/345例)、高用量で33.4% (350例/117例)に認めらました。下の表はどちらかの群で1%以上認められた有害事象について列挙してあります。標準用量群と高用量群で薬液量が増える影響で注射部位反応がやや多くなっているものの、双方の群で大きな差がないことがみてとれると思います。
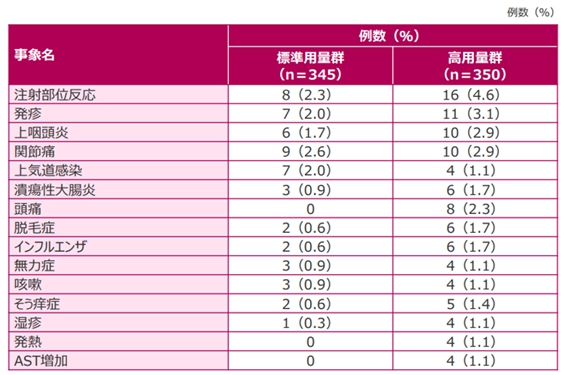
アッヴィ合同会社 社内資料より
ちなみに、ヒュミラの炎症性腸疾患以外の疾患に対する用量・用法はどうかというと、下の表の通りです。
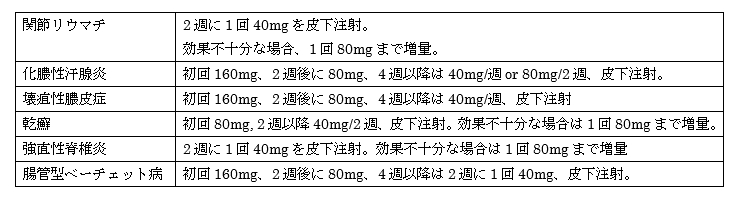
疾患によっては40mg毎週や80mg隔週投与が行われており、今回承認された高用量のヒュミラの使用実績が蓄積されていますし、安全性に関しても問題なく使用できると考えます。
ヒュミラによる維持療法期の投与方法(追加承認内容を踏まえて)
最後に、今回適応になった維持療法の投与方法について図でお示しします。
導入期→維持期に移行するタイミングで通常用量or高用量を選択できるようになっています。導入4週目の臨床症状をみてどちらの投与量で継続するか判断していくことになると思います。
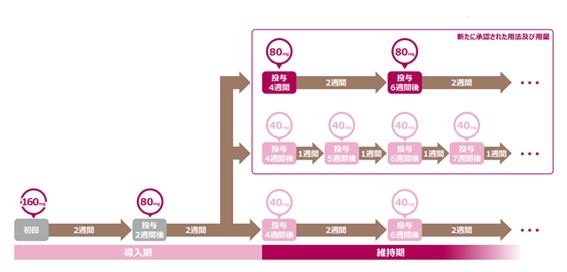
*今回のブログ中で使用した図は全てアッヴィ合同会社の社内資料よりお借りしたものです。著作権は全てアッヴィ合同会社にあります。
まとめ
- *ヒュミラの高用量投与法は通常量投与法に比べ、長期の寛解維持効果が高く、通常投与法で症状の再燃があった場合のオプションとして使用可能である。
- *新たにヒュミラで寛解導入を行う場合、当初から高用量で寛解維持を狙うことも保険適応上許容されるようになった。
- *ヒュミラの高用量投与法は、他疾患への使用実績から考えても安全性が高いと推測される。
- アーカイブ
- 2026年02月(1)
- 2025年09月(2)
- 2025年06月(1)
- 2025年05月(1)
- 2025年01月(1)
- 2024年12月(1)
- 2024年10月(1)
- 2024年09月(1)
- 2024年08月(1)
- 2024年06月(1)
- 2024年05月(1)
- 2024年04月(1)
- 2024年03月(1)
- 2024年02月(1)
- 2024年01月(1)
- 2023年12月(1)
- 2023年11月(1)
- 2023年10月(1)
- 2023年09月(1)
- 2023年08月(1)
- 2023年07月(1)
- 2023年06月(1)
- 2023年05月(1)
- 2023年04月(1)
- 2023年03月(1)
- 2023年02月(1)
- 2023年01月(1)
- 2022年12月(1)
- 2022年11月(1)
- 2022年10月(1)
- 2022年09月(1)
- 2022年08月(1)
- 2022年07月(2)
- 2022年06月(1)
- 2022年05月(1)
- 2022年04月(1)
- 2022年03月(1)
- 2022年02月(1)
- 2022年01月(1)
- 2021年12月(1)
- 2021年11月(1)
- 2021年10月(1)
- 2021年09月(1)
- 2021年08月(1)
- 2021年07月(1)
- 2021年06月(1)
- 2021年05月(1)
- 2021年04月(1)
- 2021年03月(1)
- 2021年02月(1)
- 2021年01月(1)
- 2020年12月(2)
- 2020年11月(2)
- 2020年10月(2)
- 2020年09月(1)
- 2020年08月(2)
- 2020年07月(1)
- 2020年06月(1)
- 2020年05月(2)
- 2020年04月(2)
- 2020年03月(2)
- 2020年02月(2)
- 2020年01月(2)
- 2019年12月(2)
- 2019年11月(1)
- 2019年10月(1)
- 2019年09月(1)
- 2019年08月(1)






